伦理委员会 EC / IEC / IRB
伦理委员会,一般为独立伦理委员会:指由医学、药学及其他背景人员组成的委员会,其职责是通过独立地审查、同意、跟踪审查试验方案及相关文件、获得和记录受试者知情同意所用的方法和材料等,确保受试者的权益、安全受到保护。1)
 Independent Ethics Committee (IEC):An independent body (a review board or a committee, institutional, regional, national, or
supranational), constituted of medical professionals and non-medical members, whose responsibility it is to ensure the protection of the rights, safety and well-being of human subjects involved in a trial and to provide public assurance of that protection, by, among other things, reviewing and approving/providing favourable opinion on, the trial protocol, the suitability of the investigator(s), facilities, and the methods and material to be used in obtaining and documenting informed consent of the trial subjects.2)
Independent Ethics Committee (IEC):An independent body (a review board or a committee, institutional, regional, national, or
supranational), constituted of medical professionals and non-medical members, whose responsibility it is to ensure the protection of the rights, safety and well-being of human subjects involved in a trial and to provide public assurance of that protection, by, among other things, reviewing and approving/providing favourable opinion on, the trial protocol, the suitability of the investigator(s), facilities, and the methods and material to be used in obtaining and documenting informed consent of the trial subjects.2)
Institutional Review Board (IRB): An independent body constituted of medical, scientific, and non-scientific members, whose responsibility is to ensure the protection of the rights, safety and well-being of human subjects involved in a trial by, among other things, reviewing, approving, and providing continuing review of trial protocol and amendments and of the methods and material to be used in obtaining and documenting informed consent of the trial subjects.3)
IRB和IEC基本上是同一个概念,只是用词上不同。总的来说,IRB是美国的说法,IEC是欧洲和其他国家的说法。
一、涉及人的生物医学研究应当符合以下伦理原则
- 知情同意原则:尊重和保障受试者是否参加研究的自主决定权,严格履行知情同意程序,防止使用欺骗、利诱、胁迫等手段使受试者同意参加研究,允许受试者在任何阶段无条件退出研究。
- 控制风险原:首先将受试者人身安全、健康权益放在优先地位,其次才是科学和社会利益,研究风险与受益比例应当合理,力求使受试者尽可能避免伤害。
- 免费和补偿原则:应当公平、合理地选择受试者,对受试者参加研究不得收取任何费用,对于受试者在受试过程中支出的合理费用还应当给予适当补偿。
- 保护隐私原则:切实保护受试者的隐私,如实将受试者个人信息的储存、使用及保密措施情况告知受试者,未经授权不得将受试者个人信息向第三方透露。
- 依法赔偿原则:受试者参加研究受到损害时,应当得到及时、免费治疗,并依据法律法规及双方约定得到赔偿。
- 特殊保护原则:对儿童、孕妇、智力低下者、精神障碍患者等特殊人群的受试者,应当予以特别保护。4)
二、职 责
根据《药物临床试验质量管理规范》,伦理委员会的职责是保护受试者的权益和安全,应当特别关注弱势受试者。具体如下:
(一)伦理委员会应当对临床试验的科学性和伦理性进行审查。
(二)伦理委员会应当对研究者的资格进行审查。
(三)为了更好地判断在临床试验中能否确保受试者的权益和安全以及基本医疗,伦理委员会可以要求提供知情同意书内容以外的资料和信息。
(四)伦理委员会应当审查是否存在受试者被强迫、利诱等不正当的影响而参加临床试验。伦理委员会应当审查知情同意书中不能采用使受试者或者其监护人放弃其合法权益的内容,也不能含有为研究者和临床试验机构、申办者及其代理机构免除其应当负责任的内容。
(五)伦理委员会应当确保知情同意书、提供给受试者的其他书面资料说明了给受试者补偿的信息,包括补偿方式、数额和计划。
(六)若试验方案中明确说明紧急情况下受试者或者其监护人无法在试验前签署知情同意书,伦理委员会应当审查试验方案中是否充分考虑了相应的伦理学问题以及法律法规。
(七)实施非治疗性临床试验(即对受试者没有预期的直接临床获益的试验)时,若受试者的知情同意是由其监护人替代实施,伦理委员会应当特别关注试验方案中是否充分考虑了相应的伦理学问题以及法律法规。
(八)伦理委员会应当关注并明确要求研究者及时报告:临床试验实施中为消除对受试者紧急危害的试验方案的偏离或者修改;增加受试者风险或者显著影响临床试验实施的改变;所有可疑且非预期严重不良反应;可能对受试者的安全或者临床试验的实施产生不利影响的新信息。
(九)伦理委员会有权暂停、终止未按照相关要求实施,或者受试者出现非预期严重损害的临床试验。
(十)伦理委员会应当受理并妥善处理受试者的相关诉求。
(十一)伦理委员会应当在合理的时限内完成临床试验相关资料的审查或者备案流程,并给出明确的书面审查意见。审查意见应当包括审查的临床试验名称、文件(含版本号)和日期。
(十二)伦理委员会的审查意见有:同意;必要的修改后同意;不同意;终止或者暂停已同意的研究。审查意见应当说明要求修改的内容,或者否定的理由。
(十三)伦理委员会应当对正在实施的临床试验定期跟踪审查,审查的频率应当根据受试者的风险程度而定,但至少一年审查一次。
(十四)伦理委员会应当保留伦理审查的全部记录,包括伦理审查的书面记录、委员信息、递交的文件、会议记录和相关往来记录等。所有记录应当至少保存至临床试验结束后5年。研究者、申办者或者药品监督管理部门可以要求伦理委员会提供其标准操作规程和伦理审查委员名单。
伦理委员会应当审查的文件包括:
- 试验方案和试验方案修订版;
- 知情同意书及其更新件;
- 招募受试者的方式和信息;
- 提供给受试者的其他书面资料;
- 现有的安全性资料;包含受试者补偿信息的文件;
- 研究者资格的证明文件;
- 伦理委员会履行其职责所需要的其他文件。
当发生下列情形时,研究者应当再次获取受试者签署的知情同意书:
- 研究方案、范围、内容发生变化的;
- 利用过去用于诊断、治疗的有身份标识的样本进行研究的;
- 生物样本数据库中有身份标识的人体生物学样本或者相关临床病史资料,再次使用进行研究的;
- 研究过程中发生其他变化的。
三、组成和运行要求
(一)伦理委员会的委员组成、备案管理应当符合卫生健康主管部门的要求。
(二)伦理委员会委员任期5年,可以连任。伦理委员会设主任委员一人,副主任委员若干人,由伦理委员会委员协商推举产生。5)
(三)伦理委员会的委员均应当接受伦理审查的培训,能够审查临床试验相关的伦理学和科学等方面的问题。
(四)伦理委员会应当按照其制度和标准操作规程履行工作职责,审查应当有书面记录,并注明会议时间及讨论内容。
(五)伦理委员会会议审查意见的投票委员应当参与会议的审查和讨论,包括了各类别委员,具有不同性别组成,并满足其规定的人数。会议审查意见应当形成书面文件。伦理委员会的委员应当从生物医学领域和伦理学、法学、社会学等领域的专家和非本机构的社会人士中遴选产生人数不得少于7人,并且应当有不同性别的委员,少数民族地区应当考虑少数民族委员。6)
(六)投票或者提出审查意见的委员应当独立于被审查临床试验项目。
(七)伦理委员会应当有其委员的详细信息,并保证其委员具备伦理审查的资格。
(八)伦理委员会应当要求研究者提供伦理审查所需的各类资料,并回答伦理委员会提出的问题。
(九)伦理委员会可以根据需要邀请委员以外的相关专家参与审查,但不能参与投票。
(十)伦理委员会委员应当签署保密协议,承诺对所承担的伦理审查工作履行保密义务,对所受理的研究项目方案、受试者信息以及委员审查意见等保密。7)
(十一)医疗卫生机构应当在伦理委员会设立之日起3个月内向本机构的执业登记机关备案,并在医学研究登记备案信息系统登记。医疗卫生机构还应当于每年3月31日前向备案的执业登记机关提交上一年度伦理委员会工作报告。8)
伦理委员会备案材料包括:
- 人员组成名单和每位委员工作简历;
- 伦理委员会章程;
- 工作制度或者相关工作程序;
- 备案的执业登记机关要求提供的其他相关材料。
以上信息发生变化时,医疗卫生机构应当及时向备案的执业登记机关更新信息。
伦理委员会应当建立以下书面文件并执行:
- 伦理委员会的组成、组建和备案的规定;
- 伦理委员会会议日程安排、会议通知和会议审查的程序;
- 伦理委员会初始审查和跟踪审查的程序。对伦理委员会同意的试验方案的较小修正,采用快速审查并同意的程序;
- 向研究者及时通知审查意见的程序;
- 对伦理审查意见有不同意见的复审程序。
伦理委员会的管理:9)
- 国家卫生计生委负责全国涉及人的生物医学研究伦理审查工作的监督管理,成立国家医学伦理专家委员会;
- 国家中医药管理局负责中医药研究伦理审查工作的监督管理,成立国家中医药伦理专家委员会。
- 省级卫生计生行政部门成立省级医学伦理专家委员会。
- 县级以上地方卫生计生行政部门负责本行政区域涉及人的生物医学研究伦理审查工作的监督管理。
四、发展史
塔斯基吉梅毒实验(Tuskegee Syphilis Study)
1932年,美国公共卫生部(U.S. Public Health Service)发起了一项临床试验,旨在观察梅毒患者在未经治疗的情况下,疾病会如何发展。试验选择在美国东南部的塔斯基吉进行,一个阿拉巴马州的贫穷小城。受试者则是当地患有梅毒的黑人男性患者。
梅毒是一种可怕的系统性传播疾病,发病时病人会出现红疹、全身性器官受累,严重情况下则会失明、失聪、心力衰竭、甚至死亡。


此项研究也带有明显的种族歧视。当年,美国公共卫生部和塔斯基吉大学合作,试验一共入组了611名家庭贫困的非洲裔美国黑人男性。这其中411人是在试验之前已经感染了梅毒,另外200人并没有,而是作为对照组加入试验。研究者对于试验的设计主要基于以下三点理由:
- 对于梅毒,当时已有的治疗效果并不好;
- 作为参加试验的回报,这些受试者会被给予免费的医疗、食物和保险;
- 试验计划观察6~9个月,然后给予病人免费的治疗。
听上去还OK,对吧。然后,试验开始以后,很快由于资金的短缺,研究者根本不打算对病人进行任何治疗,而且对此进行了隐瞒和欺骗,并整整持续40年。直到1972年东窗事发,试验才被终止。而这期间,青霉素早在1947年就被证明能够有效治疗梅毒,但受试者并没有得到应有的治疗。
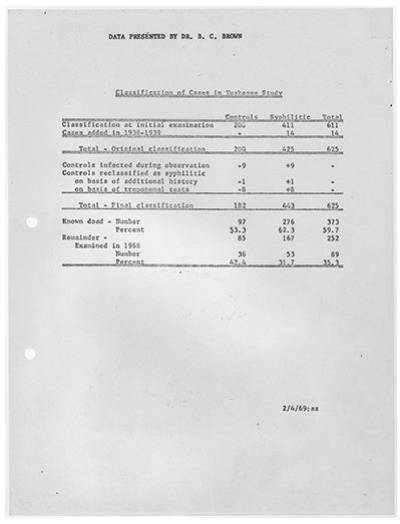
1972年7月,美国公共卫生部的Peter Buxtun在向高层多年举报未果的情况下,把试验的故事告诉给了《华盛顿星报》的记者,才首次揭开 “塔斯基吉梅毒试验” 的黑幕,旋即在美国各界、特别是黑人等少数族裔群体中引起轩然大波。试验数据显示,截止到1969年,参与实验的受试者中,对照组死亡97人,死亡率为53.3%;梅毒组死亡276人,死亡率62.3%。另外,有40人的妻子受到传染,19名子女在出生时就染上梅毒。

“塔斯基吉梅毒试验” 被认为是 “美国历史上最臭名昭著的医学研究试验”。真是它的被揭露,直接产生了《贝尔蒙报告(Belmont Report):保护人体受试者伦理学原则及准则》的出炉,和Office for Human Research Protections (OHRP) 的建立。
1974年7月12日,美国国家研究法生效,规定IRB必须在人类临床试验中切实保护受试者的权益。
“塔斯基吉梅毒试验” 的伦理问题可以概括为下面几点:
- 研究者蓄意隐瞒试验目的和试验过程,对“治疗”行为进行欺骗;
- 当地人因为缺乏医学知识,将梅毒、贫血、疲劳等都以为是“坏血病”,研究者利用了他们的无知;
- 研究者通过对病人提供免费食物、礼品、现金等“小福利”来,来诱使受试者参加试验。
1972年底,受害者集体向美国政府提起诉讼,并最终获得了900万美元的赔偿。从1973年起,美国政府开始陆续赔付。同时,经过受试者及其家人的不懈努力,在1997年5月16日,由时任美国总统的克林顿代表政府,对塔斯基吉试验中的受害者及家属正式道歉。

从1946年的十项《纽伦堡守则(Nuremberg Code)》,到1964年的《赫尔辛基宣言(Declaration of Helsinki)》,再到1978年的《贝尔蒙报告Belmont Report》。虽然,临床试验的发展历程不长,但是每一步都倍感艰辛。都是在人性的黑暗中一点一点觉醒的。