国家人类遗传资源管理
一、背景介绍
国家人类遗传资源管理 ,即 HGRAC (Human Genetic Resource Administrationof China)。
1998年,国务院办公厅转发了科技部、卫生部制定的《人类遗传资源管理暂行办法》(国办发[1998]36号)(以下简称《暂行办法》)。《暂行办法》是我国第一个全面管理人类遗传资源的规范性文件,对我国人类遗传资源的管理体制、利用我国人类遗传资源开展国际合作和出境活动的审批程序做出了规定,成为我国人类遗传资源管理的重要依据。根据《暂行办法》的有关规定,科技部于1999年开始开展“涉及人类遗传资源的国际合作项目”的行政审批工作。
2015年3月,根据工作发展的需要,中央编办将依据《暂行办法》设定的原“涉及人类遗传资源的国际合作项目审批”行政许可名称和审批任务变更为“人类遗传资源采集、收集、买卖、出口、出境审批”。根据《中华人民共和国行政许可法》的规定,并按照《国务院关于规范国务院部门行政审批行为改进行政审批有关工作的通知》(国发〔2015〕6号)等文件的要求,科技部编制并公布了《人类遗传资源采集、收集、买卖、出口、出境审批行政许可服务指南》,对我国人类遗传资源采集、收集、出口出境行为的审批流程做出了进一步规范和完善,强化了对人类遗传资源活动的全过程管理,于2015年10月开始正式实施变更名称后的行政许可审批。
二、适用范围
本许可适用于对在中国境内从事的中国人类遗传资源 采集、收集、买卖、出口、出境等事项 的规范和管理。采集适用于涉及中国境内人类遗传资源,包括重要遗传家系和特定地区人类遗传资源的采集活动;收集适用于以保藏或国际合作为目的的人类遗传资源的收集活动;按照国家相关法律法规规定禁止人类遗传资源买卖,以科研为目的的人类遗传资源转移不属于买卖;出口、出境适用于将人类遗传资源转移到境外的情形。
以临床诊疗、采供血(浆)服务、司法鉴定、侦查犯罪、兴奋剂检测和殡葬等为目的的人类遗传资源采集、收集、出口、出境活动,按照国家相关法律法规管理,不在本许可的适用范围内。
三、申请条件
(一)申请人条件
在中国境内依法成立的法人单位。
(二)审批条件
1 人类遗传资源的采集和收集。
1.1 申请开展人类遗传资源采集或收集活动应具备或符合如下条件:
(1)申请人具有负责人类遗传资源管理的相关部门并已制定相应的管理制度;
(2)经伦理委员会审查同意;
(3)有人类遗传资源提供者知情同意书格式文本;
(4)采集或收集人类遗传资源的目的明确;
(5)具备采集或收集人类遗传资源所需的人员、场所、设施、设备;
(6)有合理的人类遗传资源采集或收集计划方案;
(7)符合法律法规规定的其他条件。
1.2 由外方参与的人类遗传资源采集或收集活动属于国际合作范畴,除应满足1.1所列条件外,还需符合下列条件:
(1)由中方合作单位办理报批手续;
(2)合作各方具有开展相关工作的基础和能力;
(3)合作目的和方案明确;
(4)合作期限合理;
(5)人类遗传资源来源明确、合法;
(6)有合同文本草案;
(7)经合作各方伦理委员会审查同意并提供人类遗传资源提供者知情同意书格式文本;
(8)知识产权归属明确,分享方案合理;
(9)对中国国家安全、国家利益和公共安全没有危害。
1.3 申请开展的人类遗传资源采集或收集活动具有下列情形之一的,不予批准:
(1)申请人没有负责人类遗传资源管理的相关部门;
(2)申请人没有制定相应的管理制度;
(3)未经伦理委员会审查同意;
(4)无人类遗传资源提供者知情同意书格式文本;
(5)采集或收集人类遗传资源的目的不明确、不合法;
(6)不具备采集或收集人类遗传资源所需的人员、场所、设施、设备;
(7)人类遗传资源采集或收集计划方案不合理;
(8)可能对我国国家安全、国家利益或公共安全造成危害;
(9)法律法规规定不予批准的其它情形。
1.4 外方参与的人类遗传资源采集或收集活动,具有下列情形之一的,也不予批准:
(1)未由中方合作单位办理报批手续;
(2)合作单位不具备从事相关研究的基础和条件;
(3)缺乏明确的合作目的和方向;
(4)合作期限不合理;
(5)人类遗传资源来源不明确或不合法;
(6)知识产权归属和分享的安排不明确、不合理。
2 人类遗传资源的出口、出境。
2.1 申请开展人类遗传资源出口、出境活动应具备或符合如下条件:
(1)合作各方具有开展相关工作的基础和能力;
(2)合作目的和方案明确;
(3)合作期限合理;
(4)人类遗传资源来源明确、合法;
(5)有合同文本草案;
(6)经合作各方伦理委员会审查同意并提供人类遗传资源提供者知情同意书格式文本;
(7)知识产权归属明确,分享方案合理;
(8)对中国国家安全、国家利益和公共安全没有危害;
(9)符合法律法规规定的其他条件。
2.2 申请开展的人类遗传资源出口、出境活动具有下列情形之一的,不予批准:
(1)合作单位不具备从事相关研究的基础和条件;
(2)缺乏明确的合作目的和方向;
(3)合作期限不合理;
(4)无合同文本草案;
(5)未经伦理委员会审查同意;
(6)未提供人类遗传资源提供者知情同意书格式文本;
(7)人类遗传资源来源不明确或来源不合法;
(8)知识产权归属和分享的安排不明确、不合理;
(9)对我国国家安全、国家利益或公共安全存在可能的危害性;
(10)法律法规规定不予批准的其它情形。
2.3 因特殊情况确需临时向外提供人类遗传资源的,须填写人类遗传资源出口出境申报表及审批机关要求的其他材料,经省级科技行政部门或国务院有关部门审查同意后,报科技部,经批准后核发出口、出境证明。
四、办理材料
(一)申请材料清单
| 序号 | 提交材料名称 | 原件/复印件 | 份数 | 纸质/电子 | 要求 | 备注 |
|---|---|---|---|---|---|---|
| 1 | 申请书 | 原件 | 1 | 纸质和电子 | 网上申报填写后, 纸质盖章提交 | 开展采集、收集、出口出境 活动均需提交 |
| 2 | 组织机构代码证 | 复印件 | 1 | 纸质和电子 | 纸质盖章 | 开展采集、收集、出口出境 活动均需提交 |
| 3 | 知情同意书 | 复印件 | 1 | 纸质和电子 | 开展采集、收集、出口出境 活动均需提交 |
|
| 4 | 伦理委员会同意批件 | 复印件 | 1 | 纸质和电子 | 纸质盖章 | 开展采集、收集、出口出境 活动均需提交 |
| 5 | 采集、收集、转运合作协议 文本草案(如有合作方) | 复印件 | 1 | 纸质和电子 | 纸质 | 开展采集和收集活动需提供 |
| 6 | 国际合作协议文本草案 | 复印件 | 1 | 纸质和电子 | 纸质 | 如有外方参加需提供 |
| 7 | 食品药品监管总局出具的 临床试验批件(CFDA) | 复印件 | 1 | 纸质和电子 | 纸质盖章 | 涉及注册用药物或医疗器械 临床试验的项目需提供 |
| 8 | 法律法规要求的其他材料 | 复印件 | 1 | 纸质和电子 | 纸质盖章 | 开展采集、收集、出口出境 活动均需提交 |
(二)申请材料提交
申请人通过网上申请平台提交电子版申请材料,纸质材料可通过窗口报送或邮寄方式提交:
1. 网上申请系统链接:http://program.most.gov.cn;
2. 窗口报送:科技部行政审批受理窗口(地址:北京市海淀区西四环中路16号院4号楼,科技部中国生物技术发展中心);
3. 邮寄报送:科技部行政审批受理窗口(地址:北京市海淀区西四环中路16号院4号楼,科技部中国生物技术发展中心;邮编:100039;电话:010-88225151)。
五、办理地点
地址:科技部中国生物技术发展中心(北京市海淀区西四环中路16号院4号楼)。
乘车路线:从地铁1号线五棵松站B口出,乘坐627、634或568路公交车至公交金沟河站。
六、办理时间
办理时间:工作日8:30―11:30,13:30―16:30。
电话咨询:010-88225151,010-58881396;
电话投诉:科技部政策法规与监督司 010-58881765
七、有关部门、省级科技行政主管部门联系电话
| 序号 | 单位 | 联系电话 |
|---|---|---|
| 1 | 教育部科技司 | 010-6609 6301 |
| 2 | 卫生计生委科教司 | 010-6879 2237 |
| 3 | 中央军委后勤保障部卫生局 | 010-6688 6570 |
| 4 | 北京市科委 | 010-6615 3436 |
| 5 | 天津市科委 | 022-5883 2909 |
| 6 | 河北省科技厅 | 0311-8589 1809 |
| 7 | 山西省科技厅 | 0351-4046 686 |
| 8 | 内蒙古自治区科技厅 | 0471-6293 960 |
| 9 | 辽宁省科技厅 | 024-2398 3293, 2398 3402 |
| 10 | 吉林省科技厅 | 0431-8897 5413 |
| 11 | 黑龙江省科技厅 | 0451-8262 8292 |
| 12 | 上海市科委 | 021-2311 2497 |
| 13 | 江苏省科技厅 | 025-5771 3191 |
| 14 | 浙江省科技厅 | 0571-8705 6405 |
| 15 | 安徽省科技厅 | 0551-6264 8501 |
| 16 | 福建省科技厅 | 0591-8786 8019 |
| 17 | 江西省科技厅 | 0791-8626 2651 |
| 18 | 山东省科技厅 | 0531-6677 7086 |
| 19 | 河南省科技厅 | 0371-6596 7328 |
| 20 | 湖北省科技厅 | 027-8713 5781 |
| 21 | 湖南省科技厅 | 0731-8898 8826 |
| 22 | 广东省科技厅 | 020-8316 3902 |
| 23 | 广西自治区科技厅 | 0771-2633 078 |
| 24 | 海南省科技厅 | 0898-6532 6282 |
| 25 | 重庆市科委 | 023-6751 2607 |
| 26 | 四川省科技厅 | 028-8671 0082 |
| 27 | 贵州省科技厅 | 0851-8581 2492 |
| 28 | 云南省科技厅 | 0871-6313 6003 |
| 29 | 西藏自治区科技厅 | 0891-6823 041 |
| 30 | 陕西省科技厅 | 029-8729 4140 |
| 31 | 甘肃省科技厅 | 0931-8882 171 |
| 32 | 青海省科技厅 | 0971-8244 588 |
| 33 | 宁夏自治区科技厅 | 0951-5032 412 |
| 34 | 新疆自治区科技厅 | 0991-3838 787 |
| 35 | 新疆生产建设兵团科技局 | 0991-2896 164 |
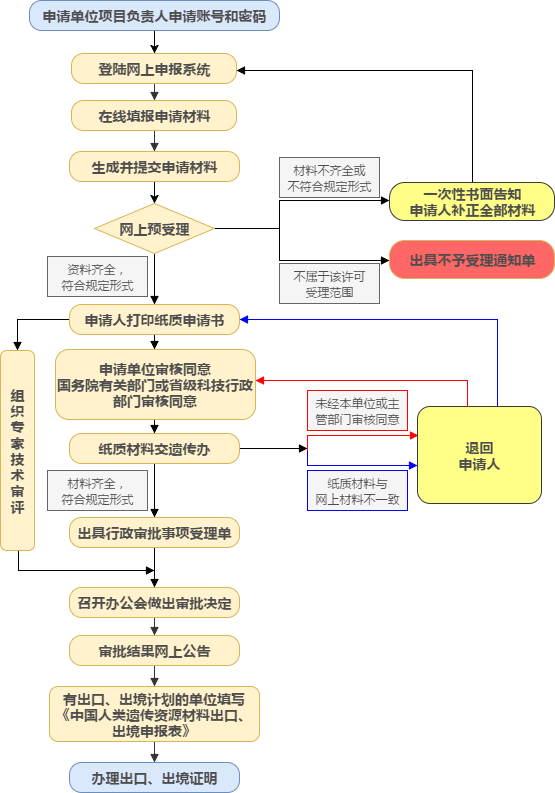
八、办理流程
本行政许可按照一般程序办理,包括申请、受理、技术评审、决定和文书送达等。
(一)网上申请
申请人通过“人类遗传资源采集、收集、买卖、出口、出境审批”网上申请平台提交电子版申请材料。
(二)网上预受理
科技部收到申请人在线提交的电子版申请材料后,在5个工作日内完成审查。对申请材料齐全、符合规定形式的,通知申请人打印纸质材料;申请材料不齐全或不符合要求的,通过网上申请平台一次性书面告知申请人需要补正的全部内容。
(三)纸质申请材料递交
申请人将网上预受理的电子版申请材料打印后,经申请单位审核盖章后,按隶属关系报国务院有关部门或省级科技行政部门,国务院有关部门或省级科技行政部门审核申请材料的真实性并加盖部门公章,申请单位向科技部递交纸质申请材料。
(四)纸质材料审查与受理
科技部收到申请人递交的纸质申请材料后,在5个工作日内完成形式审查,对申请材料齐全、符合规定形式的申请,予以正式受理并出具受理单。申请材料不齐全或不符合规定形式的,退回申请人。
(五)技术评审
科技部从人类遗传资源管理专家组中选取专家,对项目申请材料进行技术评审,提出审批决策咨询意见。
(六)办公会审批
科技部召开办公会,审核专家评审意见,做出批准或不批准的决定。
(七)结果公开
科技部以书面文件形式通知申请人,抄送其所在国务院有关部门或省级科技行政部门,并将审批结果在国务院科学技术行政部门网站公告。
(八)审批书送达
申请人凭受理单前往行政审批受理窗口领取审批书或受理窗口以邮寄方式将审批书送达。
(九)出口、出境证明办理
涉及人类遗传资源出口、出境的申请,按照科技部批准的样品出境计划填写《中国人类遗传资源材料出口、出境申报表》,提交遗传资源提供者签署的知情同意书(复印件),办理人类遗传资源材料出口、出境证明。
九、结果查询
十、常见问题
1. 以临床试验项目为例,审批时间会有多长?
答:按照《服务指南》规定,科技部将在受理单发出后的90天内签发审批书。因特殊情况确需延长审批时限的,经行政机关负责人批准,可以延长10个工作日,但须将延长时限的理由告知申请人。在实际审批工作中,科技部已采取一系列措施来加快审批进度,压缩办理时限。以2015年前三季度为例,人类遗传资源行政许可事项从正式受理申请到签发审批书的平均办理天数为40.4天。
2. 人类遗传资源管理申报过程中有哪些常见误区?
答:据了解,主要存在以下几方面认识上的误区:1.只有境外机构开展人类遗传资源研究需要审批,外资在中国境内设立机构的不需要审批;2.只要样本不出境,就不需要进行审批;3.只有人类遗传资源实体样本需要申报,其产生的相关信息不需要申报。
针对上述问题,科技部将进一步加大法律宣贯力度,积极开展相关的宣传和培训工作,全力做好电话、网络咨询工作。同时,加强对行政许可事项承担单位的监督检查力度,确保人类遗传资源相关活动依法依规开展。
3. 需要审批的人类遗传资源的范畴包括哪些?
答:根据《暂行办法》的规定,人类遗传资源是指含有人体基因组、基因及其产物的器官、组织、细胞、血液、制备物、重组脱氧核糖核酸(DNA)构建体等遗传材料及相关的信息资料。 采集适用于涉及中国境内人类遗传资源,包括重要遗传家系和特定地区人类遗传资源的采集活动;收集适用于以保藏或国际合作为目的的人类遗传资源的收集活动;按照国家相关法律法规规定禁止人类遗传资源买卖,以科研为目的的人类遗传资源转移不属于买卖;出口、出境适用于将人类遗传资源转移到境外的情形。 人类遗传资源所产生的数据等信息资料属于人类遗传资源范畴。
4. 申报拟开展的项目多长时间为宜?
答:根据《暂行办法》第十三条第五款规定,工作范围过宽、合作期限过长,则不予批准。申请单位应根据拟开展项目的实际情况合理申请,原则上最多不超过5年。如项目确实未完成,可在审批书到期时,另行申请。
5. 已批准项目在执行过程中需要新增样本检测指标的,应该如何操作?
答:已批准项目在执行过程中应严格按照科技部批准的内容和范围开展活动。在实际操作中确需增加样本检测指标的,应当按照原申请程序重新办理审批手续。
6. 以往获批的项目通过率是多少?对药物临床试验项目是否有一定的倾向性?
答:科技部严格按照《暂行办法》和《服务指南》中的相关规定和要求开展行政许可事项的审批工作,对满足审批条件的申请予以批准。自1999年启动此项审批工作至今,审批平均通过率为70%。对药物临床试验的评审标准与其他申请事项一致。
7. 应报未报项目如何补报?
答:按照新申请项目填写申请书及提交相关申请材料,申请单位另提交一份关于已开展项目情况的说明。重点说明已采集的遗传样本(或数据)仅用于本项目,不作他途。并说明剩余样本处理方式。
8. 申请未获批项目应如何再申请?
答:按照国务院审改办规范行政审批工作的相关要求,对于不予批准的申请项目,遗传办一次性告知申请者不予批准的理由。申请者可根据不予批准的理由对申请材料进行修改和完善,并再次申请,再次申请的流程与初次申请相同。
9. 知识产权归属与分享如何填写?
答:根据拟开展项目的合作协议,按照申请书填写要点如实填写中外双方在知识产权归属和分享中的相关约定。技术评审时将着重评估权知识产权归属与分享中是否存在不合理条款。
10. 中方合作单位的基础和条件应如何填写?
答:阐述性说明中方在拟开展项目中,涉及人类遗传资源相关活动的科研实力、有关制度、相关管理人员等,用于专家评估申请单位是否具备开展涉及人类遗传资源相关活动的基础。
11. 在国际合作项目中,是否由牵头单位申请?
答:遗传办对于国际合作项目中方申请单位没有限制,只要是符合申请人条件的中方单位,申请材料齐备,均可申报。
12. 数据出口出境申报的流程?
答:人类遗传资源材料相关的信息数据属于人类遗传资源范畴,其出口出境的申报流程与人类遗传资源材料(实体样本)出口出境的申报流程一致。
13. 中国内资药厂发起的临床多中心药物试验,采集、收集环节没有外资参与,是否需申报?
答:根据实际情况,如果采集环节不涉及特定地区和重要遗传家系,没有以保藏为目的的收集活动,实体样本和数据不出口出境,则无需申报。上述环节中,如果涉及受理范围的,则需要申报。
14. 中国内资药厂发起的临床多中心药物试验,但是临床遗传材料实体样本和(或)有关数据收集交由外资CRO承担,是否需要申报?
答:需要申报。中方内资药厂与外资CRO之间为国际合作,应先报批再开展。
十一、实际操作流程及注意事项
<font inherit/inherit;;inherit;;#FFFF00>(待完成)</color>