研究中心启动会(SIV)
研究中心启动会 ,即Site Initiation Visit (SIV) ,是在研究中心开始入组受试者之前,CRA对研究中心的准备情况进行检查并培训项目相关流程的方式过程。主要内容为会议讲解和答疑。
一、启动会流程
1. 启动会前
- 准备试验相关内容
- 确认人员、文件、系统、药品和仪器设备等都已到位。
- 根据公司SOP检查是否所有流程都已按要求完成。
- 确认会议时间和地点
- PI和研究中心相关项目人员一般都被要求参加启动会。
- 确认中心其他部门(如机构、伦理等)是否需要参加。
- 确认中心是否有特殊要求。
- 确认启动会现场的准备工作
- 是否需要提供投影仪、激光笔等。
- 是否需要准备工作餐。
- 准备现场需要用的文件,如签到表、授权表、方案等
- 预演
- 仔细准备PPT,并反复练习。
2. 启动会
- PPT讲演
- 一般包括方案(特别是入排标准)、SAE报告、CRF填写、药品管理、监查计划、GCP等等。
- 启动会时间有限,因此讲演需要抓住重点。
- 有时候PI不可能全程参加,趁PI在的时候要抓住重点。
- 问题记录
- 中心人员提出的问题如果现场无法回答,需要详细记录下来,待和项目组确认后再告知中心人员。
- 可以分享其他中心提出的问题及答案。
- 完成现场文件
- 签到表:与会人员都应签到,即使非项目人员。
- 因为启动会是人员最集中的时候,所以如授权表、FDF等需要多人签字的文件一般在此时集中签署。
- 补充培训
- 有时候并不是所有人员都能参加启动会,因此需要在会后单独培训,并做好记录。
- 其他检查
- 尽可能再次检查项目所有相关环节的准备情况,特别是药品、Lab Kit的储存情况,以及所需的文件表格等。
3. 启动会后
- 和项目组确认后,尽快答复启动会时没能回答的问题。
- 和中心研究者保持联系,询问受试者筛选情况。
- 如有受试者开始筛选,及时跟进、指导研究者完成首例病人的筛选。
二、启动会前后需要检查的项目及注意事项
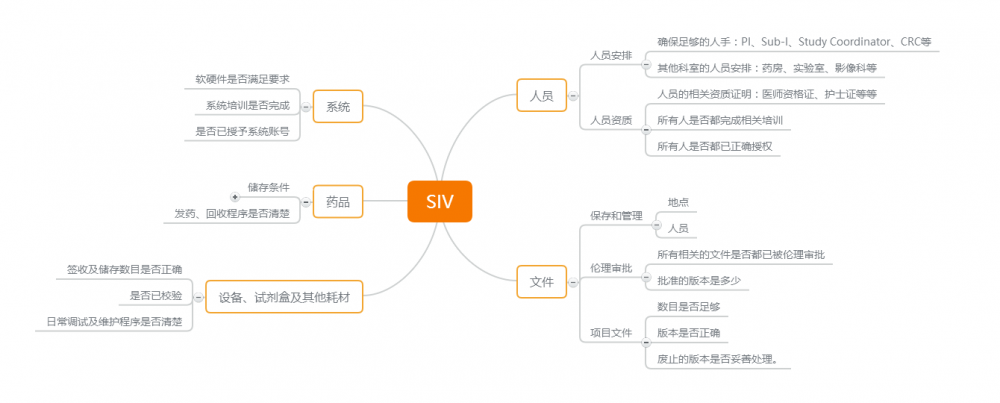
1. 人员
- 人员安排
- 确保足够的人手:PI、Sub-I、Study Coordinator、CRC等。
- 其他科室的人员安排:药房、实验室、影像科等。
- 人员资质
- 人员的相关资质证明:医师资格证、护士证等等。
- 所有人是否都完成相关培训。
- 所有人是否都已正确授权。
2. 文件
- 文件的保存和管理
- 各文件存放的地点。
- 明确文件的保管人员。
- 伦理审批
- 所有相关的文件是否都已被伦理审批。
- 批准的版本是多少。
- 项目文件是否都已准备妥当
- 数目是否足够。
- 中心使用的文件版本是否正确。
- 废止的版本是否妥善处理。
3. 系统
- 中心软硬件是否满足项目要求
- 系统培训是否完成
- 是否已授予系统账号
4. 药品
- 检查储存条件
- 储存的地点(科室或中心药房)
- 温湿度是否准确记录
- 药品接收程序及药品数目是否正确
- 发药、回收程序是否清楚
5. 设备、试剂盒及其他耗材
- 签收及储存数目是否正确
- 是否已校验
- 日常调试及维护程序是否清楚