药物非临床依赖性研究技术指导原则
国家药监局药审中心关于发布《药物非临床依赖性研究技术指导原则》的通告(2022年第2号)
2022年01月07日 发布
为指导和规范药物非临床依赖性研究,在国家药品监督管理局的部署下,药审中心组织修订了《药物非临床依赖性研究技术指导原则》。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。原国家食品药品监督管理局2007年发布的《药物非临床依赖性研究技术指导原则》废止。
特此通告。
一、概述
药物依赖性(Drug dependence)是指由于药物对生理或精神的药理作用而使机体产生反复用药的需求,以使其感觉良好或避免感觉不适。与药物依赖性有关联但有所差异的另一概念为药物滥用(Drug abuse)。药物滥用是指对药物有意的、非医疗目的的使用,以达到期望的生理或精神效应。药物滥用潜力(Drug abuse potential)则是指某一具有中枢神经系统活性的特定药物发生滥用的可能性。期望的精神效应包括欣快感、幻觉和其他感知失常、认知改变和情绪变化。具有依赖性的药物(尤其是具有精神依赖性的药物)可能导致药物滥用,因此对药物可能滥用的担忧常常是进行药物依赖性试验的重要原因。
药物依赖性包括精神依赖性(Psychological dependence)和躯体依赖性(Physical dependence)。精神依赖性,又称心理依赖性(Psychic dependence),是指基于药物的奖赏特性(产生增加药物使用可能性的正性感觉的能力)或在没有药物时产生的精神痛苦,机体对药物使用的控制力下降的一种状态。躯体依赖性是指反复用药后机体产生生理适应的一种状态,表现为突然停药或剂量明显减少后产生戒断症状。一种具有依赖性的药物,精神依赖性和躯体依赖性可能同时存在,也可能分离存在。此外,药物耐受性也是一种与药物滥用可能相关的效应。耐受性(Tolerance)是指反复使用某种药物后机体产生生理适应的一种状态,表现为机体对药物的敏感性降低,需增大剂量才能产生原有的效应。躯体依赖性或耐受性的存在并不决定一种药物是否具有滥用潜力,但是如果一种药物具有奖赏性质,则其诱导躯体依赖性或耐受性的能力可能会影响其总体滥用潜力。
具有滥用潜力的药品通常具有中枢神经系统(Central nervous system,CNS)活性,并产生欣快(或其他情绪变化)、幻觉或与CNS抑制剂或兴奋剂一致的效应。因此,对于可产生CNS活性的药物,无论什么适应症,均应考虑是否需要进行依赖性评价。
药物依赖性研究是药物非临床安全性评价的重要内容,可用于确定是否需要开展临床依赖性潜力评价,支持临床依赖性潜力评价的试验设计,并用于指导临床合理用药,警示滥用倾向。
本指导原则介绍了依赖性潜力评价分层策略、依赖性潜力早期评估内容,并重点阐述了动物依赖性行为学试验的基本要求。
本指导原则适用于中药和化学药物的非临床依赖性潜力评价和研究。
二、依赖性潜力评价分层策略
药物依赖性潜力评价采取分层评价策略,在不同的药物开发阶段获得不同的信息,并基于前期信息所反映的受试物特性,确定下一步的试验内容(详见下文阐述及附录)。
由于具有依赖性/滥用潜力的药物几乎总是具有CNS活性,因此,如果一种受试物(或人体主要代谢产物)具有CNS活性,需进行特异性的动物依赖性试验。因此,在药物依赖性潜力评价中确定受试物是否具有CNS活性非常关键。
在药物开发早期所收集的非临床数据,有助于发现依赖性潜力的早期指征。这些早期指征通常在人体首次用药前获得,包括用于确定作用持续时间的PK/PD特征、与已知依赖性药物的化学结构相似性、受体结合特性、非临床体内试验中的行为学/临床症状。
如果这些早期试验未显示受试物具有明显的依赖性潜力,则可能不需要在非临床依赖性模型中进行进一步的试验。通常,如果早期试验显示,受试物具有CNS活性,显示出已知依赖性模式相关的信号,或具有作用于中枢神经系统的新作用机制,推荐进行进一步的非临床依赖性试验以支持大规模的临床试验(如Ⅲ期临床试验)。
此外,在获得人体药代动力学数据后,需要关注人体主要代谢产物[参考ICH M3(R2)及其问答对代谢产物非临床研究的要求]是否具有依赖性风险,是否具有CNS活性,是否在原形药的非临床研究中进行了充分评估,必要时需进行单独的依赖性潜力评价相关试验。该部分试验通常应在大规模的临床试验(如Ⅲ期临床试验)前完成。
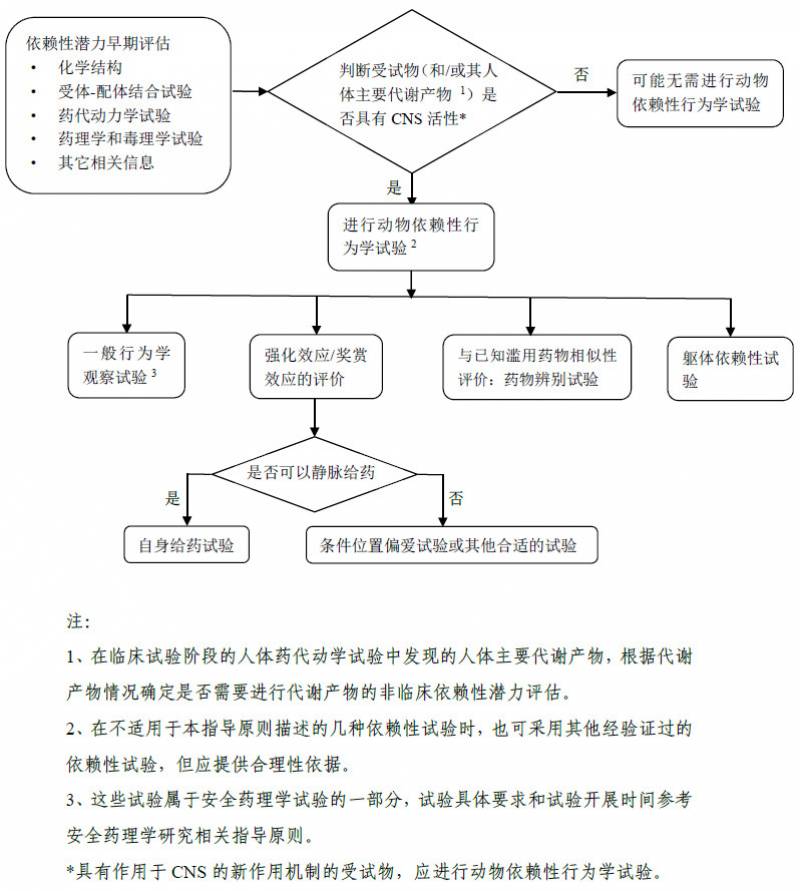
三、依赖性潜力早期评估
受试物是否具有 CNS 活性是进行非临床依赖性试验的前提条件,因此在药物开发早期,需综合相关信息来评估受试物是否具有CNS活性,对依赖性潜力进行初步评估。评估时需考虑以下方面:
与已知具有依赖性的药物的化学结构具有相似性;受体-配体结合试验显示受试物可能作用于与依赖性相关的靶点/位点;药代动力学提示受试物(和/或其主要代谢产物) 可通过血脑屏障而分布于脑组织;药理学和毒理学试验中提示的CNS活性或提示依赖性的指征;等。
(一)受体-配体结合试验
对于CNS活性药物,受体-配体结合试验通常是药物早期开发的一部分。因为其可以确定受试物与已知参与药物依赖性的靶点/位点的结合,所以从这些数据中可获得指示依赖性的第一信号。
应使用体外受体-配体结合试验进行全面筛选,以确定受试物在脑中的药理作用位点。CNS 可能的作用位点包括受体、转运蛋白和离子门控通道系统。值得注意的是,新的药理作用机制可能与先前无法识别的人类滥用/依赖性潜力有关。
与滥用/依赖性潜力有关的神经系统靶点/位点包括(但不限于)如下:阿片、多巴胺、5-羟色胺、大麻素、γ-氨基丁酸(GABA)、N-甲基-D-天门冬氨酸(NMDA)受体, 转运体(如多巴胺、5-羟色胺、GABA),离子通道复合物(如钙、钾、氯)。
全面的受体-配体结合试验通常评估CNS中的许多靶点/位点,目前仅已知其中一部分与滥用/依赖性潜力相关。但是,以前被认为与滥用/依赖性潜力不相关的作用机制的新药可能也会产生与滥用/依赖性有关的信号。尽管大多数所测定的靶点/位点并不能直接预测药物滥用/依赖性,但是它们可以预测在与滥用相关试验中可能观察到的某些动物行为和人体不良事件。
在进行受体-配体结合试验时,应遵循一般的科学原则, 包括使用合适的阳性对照和内控标准。应尽可能使用高选择性的放射性配体。配体的浓度应至少为10μM(或应相当于预期的治疗暴露量的若干倍)。
对于受体-配体结合试验的数据,应对特异性(配体是否在一个或多个位点结合)和选择性(配体对不同结合位点的相对亲和力)两方面进行评估。
对具有结合力的靶点/位点,进一步在细胞水平进行体外功能性试验,以确定受试物在特定结合位点是激动剂、拮抗剂、部分激动剂还是混合激动剂-拮抗剂。功能性试验包括神经递质释放、第二信使活性的测定等。
通过对受体-配体结合和功能特性的了解,有助于确定哪些动物行为学试验可能是相关的。
根据体外受体-配体结合的试验结果,后续可能需要在体内试验中进一步确认体外试验中观察到的结合特性。
以上内容也适用于在临床试验阶段的人体药代动学试验中发现的人体主要代谢产物。
(二)药代动力学研究
来自药代动力学研究的依赖性早期指征包括在脑中的相对分布和穿透性,受试物若能透过血脑屏障进入脑,或者代谢产物能进入脑或在脑中形成代谢产物,可能提示受试物是否具有CNS活性。 此外,非临床药代动力学资料对于合理设计和解释与动物依赖性试验非常重要,例如原形药和具有CNS活性的人体主要代谢产物(高于药物相关总暴露量的10%)的血浆峰值浓度(Cmax)、达峰时间(Tmax)、药物作用起效时间和终末半衰期(T½)。其他参数,例如曲线下面积(AUC0-∞)、生物利用度、CNS 浓度及药物清除率,可能对于某些药物也很重要。
(三)药理学和毒理学研究
药理学和/或毒理学试验显示受试物能够诱导动物出现提示CNS活性的一般行为学变化。例如:在药效学试验中出现的 CNS 相关反应,重复给药毒性试验中停药后恢复期中出现的异常行为或戒断症状。
通过以上研究及相关信息,如果经评估后认为受试物具有CNS活性,则需要进行进一步的动物依赖性行为学试验。如果受试物显示出已知的依赖性模式有关的信号,或者具有作用于CNS的新作用机制,也需要进行进一步的动物依赖性行为学试验。
但是,经过对相关信息的评估后,若同时符合以下三种情况,可能不需进行进一步的动物依赖性行为学试验:(1)在相关浓度下,受试物与依赖性相关的分子靶点无相互作 用,或者虽然观察到受试物与相关靶点的结合,但该结合不会引起相应的功能性变化。(2)体内试验结果未显示出依赖性潜力。(3)未发现受试物具有可能与依赖性有关的新的作用机制。
当体外试验中已充分显示出依赖性潜力的类别和程度, 例如一个完全μ阿片受体激动剂,可能不需再进行进一步的研究。但是,此类阿片类药物常常表现出混合的阿片类特征, 需要进一步的试验来研究其依赖性。
如果在后续的动物或人体试验中受试物出现提示依赖性潜力的信号,应重新考虑是否需要进一步的药物依赖性试验。
四、动物依赖性行为学试验
在确定受试物和/或其主要代谢产物具有CNS活性后,应进行与依赖性相关的动物行为学试验。这些试验评价受试物在动物体内是否能引起行为变化,从而提示人体是否可能对受试物产生依赖性,是否有滥用风险。非临床安全性试验中的一般行为学试验检测受试物是否影响或干扰一般行为,可显示受试物是否产生与依赖性相关的信号(例如提示中枢兴奋的过度活跃)。特异性的依赖性试验包括评价受试物是否具有奖赏或强化特性(自身给药试验和条件性位置偏爱试验),以及受试物是否与已知的滥用药物具有类似的效应(药物辨别试验),此外,还应评价受试物在长期给药后产生躯体依赖性的潜力(可通过突然停药后出现戒断症状来提示,即戒断试验)。这些特异性的依赖性试验即通常毒理学试验中所称的药物依赖性试验。这些特异性依赖性试验的结果,与临床试验中与滥用相关的不良事件的评价相结合,用于确定是否需要进行人体依赖性/滥用潜力研究以及如何设计试验方案。
一般情况下,评价药物依赖性需完成三类特异性的依赖性试验:药物辨别试验、自身给药试验和戒断评价试验。当进行试验时,自身给药试验和药物辨别试验通常为单独进行。戒断评价试验可单独进行,在可行时也可整合到重复给药毒性试验恢复期的设计中。
一般情况下,特异性的药物依赖性试验在Ⅱ期临床试验结束后进行,因为此时才可获得拟定的最终治疗剂量,而依赖性试验的给药剂量需基于人在拟最高治疗剂量时所产生的暴露量进行设计。但是,根据受试物具体情况,如基于安全性风险的担忧或其他因素,可能需要在药物开发更早阶段进行依赖性试验。这种情况下,在获得拟定的最终治疗剂量后,需再评估这些试验的设计是否满足要求,必要时需重新进行依赖性试验。
为了获得足够的药物依赖性信息,药物依赖性试验内容的选择需综合依赖性潜力早期评估结果、前期药理毒理资料(包括药效学、毒理学、药代动力学、安全药理学等)、已有的人体试验提示信息,以及人和动物的代谢差异性等,并进行合理的试验设计。在不适用于本指导原则所描述的几种药物依赖性试验时,可采用其他经验证过的依赖性试验,但应提供合理性依据。
(一)试验一般原则
药物依赖性试验是药物非临床安全性研究的一部分,应当在经过药物非临床研究质量管理规范认证的机构开展,并遵守药物非临床研究质量管理规范。
药物依赖性的评估和试验设计,应在对受试物认知的基础上,遵循具体问题具体分析的原则。应根据前述早期依赖性潜力指征的评估,选择合理的试验方法,设计适宜的试验方案,并对试验结果进行全面的分析与评价。
试验设计应符合毒理学试验随机、对照、重复的基本原则。
(二)受试物
中药、天然药物:受试物应采用能充分代表临床试验拟用样品和/或上市样品质量和安全性的样品。应采用工艺路线及关键工艺参数确定后的工艺制备,一般应为中试或中试以上规模的样品,否则应有充分的理由。
化学药物:受试物应采用工艺相对稳定、纯度和杂质含量能反映临床试验拟用样品和/或上市样品质量和安全性的样品。
受试物应注明名称、来源、批号、含量(或规格)、保存条件、有效期及配制方法等,并提供质量检验报告。试验中所用溶媒和/或辅料应标明名称、标准、批号、有效期、规格和生产单位等,并符合试验要求。
应进行受试物样品分析,并提供样品分析报告。
(三)实验动物
当受试物在啮齿类动物中的代谢产物特征和药物作用靶点与在人体中的一致时,应采用啮齿类动物进行依赖性评估。一般不采用非人灵长类动物,只有在少数情况下,有明确的证据表明非人灵长类动物可预测人体依赖性而啮齿类动物模型不能预测时,才采用非人灵长类动物进行试验。
依赖性试验通常采用大鼠,因为大鼠在这些试验中已得到了验证并广泛使用。
依赖性试验通常采用两种性别动物。若采用一种性别, 需提供合理性证据。
试验中的动物数应基于统计学分析效能,以确保动物数适合于检测到与受试物相关的行为学变化。
如果已知并可获得试验中所用动物的用药史(包括药物类别及用药的程度和时间等),应提供,因为既往用药可能影响动物对受试物的反应。
(四)给药剂量
应根据所进行的具体试验、受试物的特性选择合适的给药剂量。给药剂量应基于人拟用最高治疗剂量产生的最大血药浓度(Cmax)进行设计,最高剂量产生的血药浓度应为临床治疗剂量下血药浓度的若干倍。由于药物滥用者/吸毒者使用剂量通常是临床使用剂量的数倍,故动物依赖性试验中的剂量应为相当于临床最高治疗剂量产生的Cmax至比其高数倍(该原则不适用于自身给药试验,详见2.1 自身给药试验)。
另外,若受试物对与依赖性相关的靶点具有部分激动剂活性(高剂量时产生拮抗剂活性,低剂量时产生激动剂活性),而适应症与拮抗作用相关,对于此种受试物,给药剂量适当降低可能更适合于评价依赖性潜力。
(五)给药途径
原则上采用临床给药途径,但是对于不同的模型可能需要采用不同的给药途径。如自身给药试验应采用静脉给药途径(详见2.1 自身给药试验)。另外,需考虑以后的滥用/非医疗目的可能使用的不同给药途径。
(六)对照组
应设置阳性对照组和阴性对照组。
为了验证试验系统的敏感性和有效性,阳性对照组应产生与阴性对照组在统计学上有显著差异的结果,以确保可检测到依赖性潜力。在可行的情况下,阳性对照药应与受试物
属于同一药理学类别且已知具有依赖性。阳性对照药的剂量应合理选择,如参考已发表的依赖性试验文献,以确保在具体试验中能产生足够的依赖性行为反应。对于具有新的作用机制的受试物,则阳性对照药可考虑选择作用机制不同,但适应症或行为学特性与受试物相似的药物。
阴性对照组一般采用受试物的溶媒或辅料。
(七)指标检测时间
动物行为学试验的指标检测应在Tmax时进行,并另外在Tmax前和后进行检测,以确保完整表征受试物。由于Tmax取决于给药途径,因此应参考动物PK试验数据设计合适的指标检测时间点。检测开始的时间取决于所评价的特定动物行为,因为在药物起效时不同的行为反应可能会发生于不同的时间。
需要关注耐受性对试验检测时间点的影响。动物依赖性潜力评估通常不需要直接评价耐受性,但是,应知晓受试药的药理机制是否与耐受性的发展有关。如果有关,这会影响行为训练和测试的时间,以使药物暴露的频率不足以引起耐受性。如果未控制耐受性的可能性,则通常无法肯定地将试验阴性结果解释为未显示出依赖性信号。对于具有新作用机制的受试物,如果受试物的给药频率不高于每两天给药一次,则产生耐受性的可能性较低。
戒断评价试验中,观察时间和频率应足以检测到所有的戒断症状。
(八)各试验一般要求
1. 一般行为学试验
可能提示依赖性信息的一般行为学试验包括功能行为组合(FOB)试验/Irwin’s 试验、运动能力试验等。FOB试验/Irwin’s 试验为在动物急性给药后的一段时间内(包含Tmax)观察一般行为,可提供受试物是否会产生与依赖性/滥用相关的作用(如兴奋剂或镇静剂)的初步指征。运动能力试验为动物急性给药后检测受试物干扰正常运动功能的能力,包括运动行为观察(包括刻板行为)、转棒行为、翻正反射、肌张力观察(如悬尾试验)、斜板试验等。这些试验通常属于安全药理学试验的一部分,试验具体要求和试验开展时间参考安全药理学研究相关指导原则。
2. 奖赏效应/强化特性的评价
2.1 自身给药试验
自身给药试验(Self-administration study)用于评价受试物是否具有足以产生强化作用的奖赏效应,即动物在初次接触受试物后反复自身给药的可能性。
自身给药试验原理基于斯金纳的操作式条件反射,动物通过无意间的行为(如踏板或压杆)获得药物,药物所带来的欣快感强化了动物继续踏板行为,最终通过不断的药物强化,动物学会了主动觅药。在建立操作式条件反射过程中, 通常伴随着声音刺激或(和)光刺激,以使动物获得条件性强化能力。
自身给药试验应采用静脉给药途径,因为静脉给药途径可使药物快速进入大脑,更易使药物摄取行为(如踏板/压杆)与即时药物作用之间相关联。最常用的给药途径为颈静脉给药途径。受试物的单次摄取剂量应适当,不能过高,数次摄取后的总给药剂量所产生的暴露量一般与人体拟治疗剂量产生的暴露量相似或为若干倍,以使在无药物立即过量风险的情况下可以对动物重复给药,并避免过高剂量单次给药后立即引起的精神满足感,而该精神满足感将影响强化作用的评估。
自身给药试验的训练阶段一般采用固定比率(fixed ratio)1 至FR10的训练,最终测试应使用标准FR10。
某些类型的具有致幻作用的药物,因具有奖赏特性而已知在人类中滥用,通常不会产生动物自身给药行为(例如5HT2A激动剂),或者仅在有限条件下产生动物自身给药行为(例如大麻素)。因此,对于与这种类型药物的作用机制或行为效果相似的受试物,不建议进行自身给药试验,建议选择其他合适的精神依赖性试验。
对于无法静脉给药的受试物,不适用于自身给药试验, 可选择条件位置偏爱试验或其他合适的试验。
2.2 条件位置偏爱试验
条件位置偏爱(Conditioned place preference,CPP)试验用于评价受试物是否能够产生奖赏效应,这种效应通过动物偏爱伴药箱而不是偏爱非伴药箱来体现。
CPP试验基于巴普洛夫的经典性条件反射,把奖赏刺激(药物)与非奖赏刺激(特定环境)反复关联后,后者可获得奖赏特性。这可使在不给予药物的情况下,动物仍表现出对该特定环境的偏爱。
CPP试验与自身给药试验的不同之处为CPP试验不检测药物的奖赏效果是否产生强化作用。CPP试验也被认为不如自身给药试验敏感或可靠。但CPP试验不受给药途径的限制,只要在Tmax时进行试验,给药途径则不是关键因素。
3. 与已知滥用药物效应相似性的评价
药物辨别试验(Drug discrimination study)
药物辨别试验用于评价受试物是否产生与已知的滥用药物(训练药物)相似的“主观感受”。
依赖性药物使人产生的情绪效应如欣快、满足感等,属于主观性效应。具有主观性效应的药物可以控制动物的行为反应,使之产生辨别行为效应。药物辨别试验属操作式行为实验。药物辨别试验可适用于不同的给药途径。
药物辨别试验一般分为食物训练阶段、强化训练阶段和挑战测试阶段。动物通常接受固定比率 10(FR10)的强化训练,测试阶段也采用 FR10。挑战测试阶段需进行阳性对照、阴性对照和受试物的挑战测试。当动物按压与训练药物相关的踏板/杆>80%时,认为受试物与训练药物“完全泛化”;当动物按压与训练药物相关的踏板/杆<20%时,则为 “无泛化”;两者之间为“部分泛化”,其中 60~80%之间的部分泛化被认为与训练药物所产生的“主观感受”有相似之处。
如果受试物对训练药物(已知的滥用药物)产生完全或部分泛化,则被认为可能具有滥用潜力。但是,由于药物辨别依赖于作用机制,只有药理活性与训练药物相似的受试物才有可能对训练药物产生泛化。
4. 躯体依赖性的评价
躯体依赖性评价通常采用戒断试验,评价受试物长期重复给药后突然停药是否会产生戒断症状。该评价可整合于重复给药毒性试验中,在其试验给药结束时进行,也可单独开展试验。大部分具有依赖性的药物达到生理适应后,突然停药或剂量明显降低时通常会产生躯体戒断症状,如阿片类药物戒断后产生流泪、流涎、腹泻、竖毛、湿狗样抖动等症状。不同药理学类别的药物往往产生不同的戒断综合征。
躯体戒断试验包括自然戒断试验和催促戒断试验,前者通过给药几周后直接停药观察戒断症状,后者则一般在较短时间内采用剂量递增方式给药并采用对应的拮抗剂快速催促激发戒断反应。戒断症状出现的进展及程度取决于药物类别、给药途径、给药剂量、作用持续时间等。
首选自然戒断试验。一般采用产生与人治疗剂量(以及可能超治疗剂量)暴露量相当的剂量给药至少4周,然后突然停药。行为观察应在停药前几天开始,每天观察至少持续7 天,或直至受试物消除的时间。由于不同药理学类别药物通常产生不同的戒断症状(可能存在部分重叠),应使用药理学类别药物预期戒断行为的标准化检查表。
五、非临床依赖性试验结果综合分析与评价
在对非临床依赖性试验数据进行分析与评价时,建议考虑以下几方面:
1. 对于药物依赖性试验,试验系统可靠性和敏感性非常重要,应基于阴性对照和阳性对照药的结果评价试验系统的有效性。不同的药理学作用类别可能适用于不同的试验或试验设计,因此应综合评价所选择试验及其试验设计的合理性,阐述模型是否可靠,检测指标是否具有灵敏性、特异性和可靠性。
2. 由于行为学试验受到的影响因素多且动物之间变异性大,对于每个试验的结果,需综合分析其统计学意义和生物学意义。统计学差异可判断受试物对所考察的试验结果是否存在影响,但由于样本数的限制,有时可能掩盖真正的生物学差异,故样本数应足够充分,以满足统计学效能的需要, 同时,还应对每个样本试验结果进行分析。同时还可结合动物的正常反应加以分析。
3. 应分析是否存在耐受性,以及耐受性是否影响依赖性潜力的评估。
总之,在对受试物依赖性风险评估中,应充分利用所有的非临床研究数据,并结合药学、药理毒理和临床研究信息, 进行科学客观的分析和综合评价,以判断是否具有依赖性潜力,提示是否需要进行人体依赖性潜力评估试验以及为人体依赖性试验设计提供信息,并提示药物分类信息,指导临床合理应用,避免药物滥用的发生。
六、参考文献
[1] ICH. M3(R2): Guidance on Nonclinical Safety Studies for the Conduct of Human Clinical Trials and Marketing Authorization for Pharmaceuticals 2009.
[2] FDA. Assessment of Abuse Potential of Drugs Guidance for Industry. 2017.
[3] EMEA. Guideline on the Non-Clinical Investigation of Dependence Potential of Medicinal Products. 2006